创新药的春天来了,可临床试验的能力还差得远……
本文转自:子不语,医学界
创新药的春天已来,但我国的药品临床研究水平亟待提升。
4月24日,由南京生物医药谷发展中心主办,中国外商投资企业协会药品研制和开发行业委员会(RDPAC)、江苏省产业研究院生物医药和医疗器械科技服务中心联合协办的“构建可持续发展的医药创新生态系统研讨会”在南京国家级江北新区举办。
会上,行业专家表示:我国临床研究的能力和资源问题若得不到及时解决,将至少延缓中国创新药产业发展进程五到十年。专家呼吁,要从顶层设计层面提升对临床试验的重视程度。
我国当前的临床研究总体发展缓慢
新药研发是一个漫长而复杂的创新过程,伴随着高投入、高风险。一个新药从发现到成功上市通常要花费10-15年。其中,药物临床试验是新药研发过程中耗时最长(平均6-7年)、成本最高(约占总费用67%)的阶段。而临床试验面临诸多不确定性,有关数据显示临床试验阶段的药物只有不到12%最终被批准上市。
“目前我国药品临床试验的平均启动时间约为14-20个月,美国整体需要6至9个月时间,韩国仅需要4至6个月。”研讨会上,RDPAC科学与药政事务高级总监闫慧现场做了主题报告:推动临床研究体系设计与实施,深化医药创新生态系统构建。
该报告从四项指标分析我国与包括美国、英国、德国在内的另外11个全球主要医药创新国家在临床试验水平上的差异,分别是干预性临床试验总数(不计入生物等效性试验)、Ⅰ期临床试验数量、国际多中心临床试验总数和顶尖临床研究论文数量。结果显示,我国当前的临床研究总体水平在世界创新领先国家中排名第九,在亚洲位列日本和韩国之后。

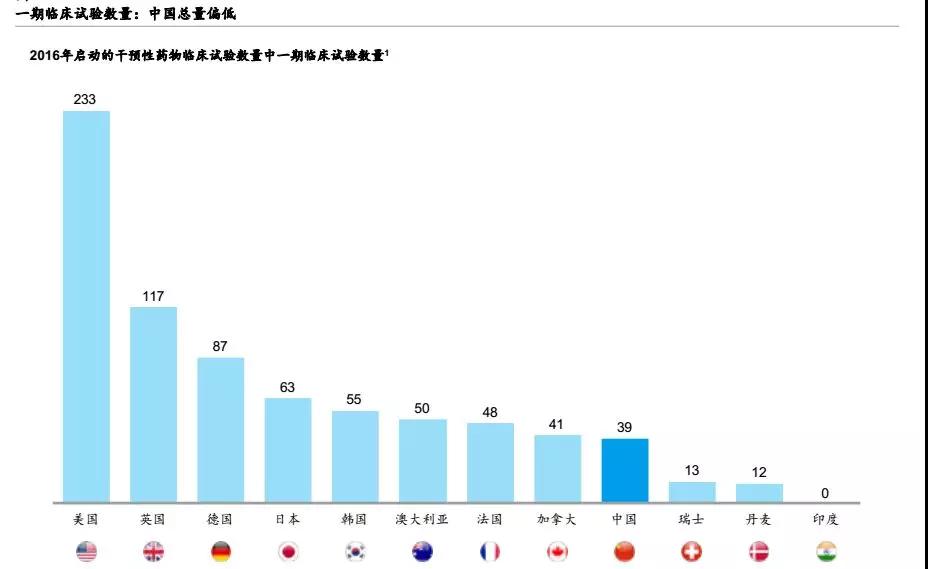
从2016年启动的由药企发起的干预性药物临床试验量(不计入生物等效性试验)中Ⅰ期临床试验的数量来看,我国与领先国家的差距进一步显现,此项的前三名美国、英国、德国分别发起了233项、117项和87项试验,我国的数据则仅为39项。
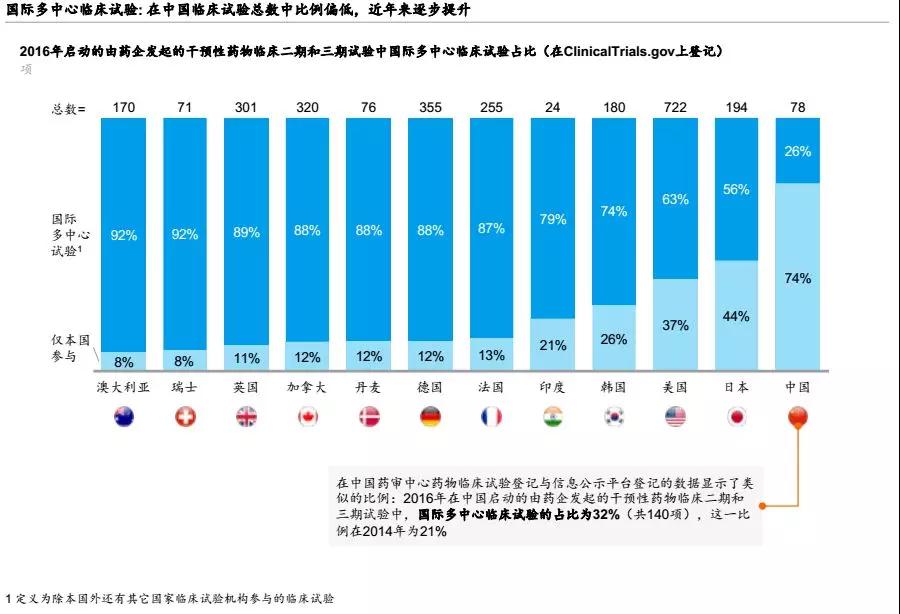
从2016年启动的由药企发起的干预性药物Ⅱ期、Ⅲ期临床试验中国际多中心临床试验的比重来看,我国的数据为26%,排名居末位。
制度“松绑” 临床试验大放开
鼓励药物研发创新是我国从医药大国走向医药强国的必经之路。自2015年44号文《国务院关于改革药品医疗器械审评审批制度的意见》以来,有关加快药品审评、放开临床试验等对医药行业利好的政策频发。
国家食品药品监督管理总局(CFDA)于2017年5月11、12日两天内连发四文,包括关于“鼓励药品医疗器械创新加快新药医疗器械上市审评审批”、“鼓励药品医疗器械创新改革临床试验管理”等。
2017年10月8日,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,就改革临床试验管理、加快上市审评审批、促进药品创新和仿制药发展等提出36条意见。
2017年10月10日,就鼓励新药上市创新意见的具体落地,总局公布《关于调整进口药品注册管理有关事项的决定》,对进口药品注册临床试验等相关事项作出调整。
2017年10月23日,总局公布《中华人民共和国药品管理法修正案》(草案征求意见稿)主要修改内容包括落实行政审批制度改革要求,将临床试验机构的认证由审批制改为备案制等。
2017年10月27日,总局公开征求《药物临床试验机构管理规定(征求意见稿)》意见,规定了临床试验机构由资格认定转变为备案制的细则。临床试验机构的设立将从事前审批监管转变为事后备案监管,此即意味着临床试验机构的设立门槛更低,但同时符合药物临床试验质量管理规范(GCP)的责任则转移至临床试验机构。
去年6月,中国国家食品药品监督管理总局成为国际药品技术要求协调组织(ICH)正式成员。曾有专家预测,CFDA加入ICH后,我国药品审评审批改革的步伐将进一步加快。
在一系列政策“松绑”下,效果明显。2017年,国家食药监总局药品审评中心审评通过批准创新药临床试验申请399件,共涉及170个品种,较2016年创新药临床试验批准数量翻了一番。这170个品种中,抗肿瘤药物、消化系统药物和内分泌系统药物较多,占全部创新药临床试验批准数量的65%。
提升临床研究能力的关键在“人”
“目前全国有600多家药物临床试验机构。大部分研究机构的流通量饱和度远远不足,仅承接少量项目,而顶级的临床机构项目排得很满,流通量已经饱和到极限。”
政策松绑之后,与会专家指出,临床试验依然面临不少问题。其中,临床研究能力和资源不足是制约中国临床研究水平提升的主要因素。研究者,是决定临床试验质量的核心因素。
过去三年,美国食品药品管理局(FDA)批准的37个首创新药背后的多中心关键性研究共关联40篇研究论文,其牵头研究者中并无中国研究者的身影。而从人才引进的角度看,临床研究方面的高水平人才引进也存在缺憾。以2015年第十一批“千人计划”青年项目为例,661位“千人计划”青年人才中仅有3人的学科与医学相关。“他们的研究方向是基础医学,跟临床研究还有一定的距离。”
2014年~2016年,仅三分之一的药物临床试验机构参与过超过20项临床试验。而在参与过国际多中心临床试验的274家机构中,仅约三分之一的机构在过去三年中承担过10项以上国际多中心临床试验。
这些数字折射的现实是,我国研究者团队在过去没有办法参与国际最顶尖的临床试验,临床试验机构在临床试验方面相对薄弱。
报告指出,临床研究的“主战场”在医院,主体是医生。但我国尚未建立起有效的医院和医生激励机制,鼓励和支持研究者开展临床研究。医疗人才教育培养体系和国家人才计划也对临床研究重视不足。这些问题导致了临床研究的高水平人才匮乏,医生总体参与程度和积极性不高。
在医院的等级和专科评定标准中,临床研究所占比重偏低,在《三级综合医院评审标准》的636项条款中,仅两条涉及临床试验,国家临床重点专科评估中仅肿瘤科和药学科涉及临床试验相关指标,分值比重也并不高。而在对医院负责人和医护人员的绩效考核指标体系中,对承担和参与临床试验的情况认可度也不高。因此,医护人员开展临床研究的动力不足。
目前,中国在顶尖基础研究生物医学杂志上发表的论文数量不断攀升,2014-2016年发表在《自然》《科学》和《细胞》上的相关论文数量在全部12个国家中排名第4,仅落后于美国、英国和德国。但是以临床研究为主的杂志《柳叶刀》《新英格兰医学杂志》《美国医学会杂志》上发表的文章数,我国的文章数为29篇,此项的前三名美国、英国和加拿大的数量依次为1084篇、321篇和110篇。
对此,专家建议应加强对承接临床研究的医疗机构和研究者团队的激励机制。首先,从医院层面上看,应改革医院和专科等级评定和绩效考核办法,鼓励医院开展临床研究;其次,从医生层面上看,应改革医生职称评定和绩效考核办法,鼓励医生开展和参与临床研究;再次,应探索设立研究型医生职业发展路径,制定专门的职称评定标准和绩效考核方式,鼓励有兴趣有能力的医生投入更多时间开展临床研究。
会上,专家还就临床试验研究中的伦理审查现状及面临的主要挑战,生物等效性(BE)研究的质量管理存在的问题进行了专题讨论。
扫一扫 手机端浏览




